2. 南京大学声学研究所, 南京, 210093
2. Institute of Acoustics, Nanjing University, Nanjing, 210093, China
高强度聚焦超声(High intensity focused ultrasound, HIFU)作为一种新兴的现代疗法,使超声的能量在毫米级聚焦区被局部吸收,可以引起局部组织坏死或烧灼出血点而不损害其他组织,其在非侵入性癌症的治疗方面具有广阔的前景。目前大多数HIFU治疗中都使用了非常高的声强,并将由此产生高温[1-4],因此必须重视并确保HIFU治疗安全性。在HIFU治疗的过程中,大幅度的稀疏压力振幅可以使周围组织在足够张力的前提下,迅速形成充满气体和蒸汽的空腔,而随后的超声波聚焦将使这些气泡产生声空化[5-7]。目前已经证明超声焦域存在空化,而且可以使组织加热率稳步提高[8-12]。因此可以认为,提高加热速率能够促进损伤形成,但该过程的完成依赖于聚焦的超声参数[1-2]。
HIFU是一个多参数物理系统,其中声压、脉冲长度及平均重复频率(Pulse recurrence frequency,PRF)等参数会对温度及组织损伤形成造成影响。Khokhlova等从理论及实验两方面研究了非线性声传播、汽化泡及空化泡对HIFU治疗中组织损伤形成的影响[13]。研究表明热效应产生的组织损伤是椭圆形,而空化效应产生的组织损伤会成为“蝌蚪”形。尽管文献[13]研究表明汽化泡及空化泡对组织损伤的形成有影响,但缺乏空化泡对组织损伤影响的定量研究。
本文将通过空化效应的定量测量,以定量探讨空化效应对组织损伤形成的影响。首先理论上采用KZK非线性方程和Pennes生物传热模型,模拟了不同超声激励参数的HIFU热效应产生的组织损伤。然后在实验中改变脉冲长度和声压,比较实验与理论上产生的损伤形成。最后采用B型成像系统定量监测产生的声空化,从而定量分析空化效应对损伤形成的影响。
1 理论与方法 1.1 非线性声学与生物传热模型温升及热致组织损伤的仿真中采用广泛使用的非线性KZK方程来描述组织的非线性超声传播[14],表达式为
| $ \frac{{{\partial ^2}p}}{{\partial z\partial t'}} = \frac{{{c_0}}}{2}{\Delta _ \bot }p + \frac{b}{{2{\rho _0}c_0^3}}\frac{{{\partial ^3}p}}{{\partial {{t'}^3}}} + \frac{\beta }{{2{\rho _0}c_0^3}}\frac{{{\partial ^2}{p^2}}}{{\partial {{t'}^2}}} $ | (1) |
式中:等式右边3项分别代表衍射、衰减、非线性效应;p, ρ0, c0,b和β分别代表声压、传播介质密度、声波速度、耗散参数和非线性系数;直角坐标系的拉普拉斯算符为
设
| $ \frac{{{\partial ^2}p}}{{\partial \tau \partial Z}} = \frac{1}{{4G}}{\Delta _ \bot }p + A\frac{{{\partial ^3}P}}{{\partial {\tau ^3}}} + \frac{N}{2}\frac{{{\partial ^2}{P^2}}}{{\partial {\tau ^2}}} $ | (2) |
式中:ω, P0, a和F分别表示角频率、换能器表面声压、换能器的直径和焦距;G=ka2/(2F),其中k为超声波波数;A=αF,其中α为基频f0下的衰减系数;N=F/ld,其中ld=ρ0c03/(βωP0)为冲击波形成距离,描述非线性效应,ρ0表示密度。该方程可以结合测量校准技术获得边界条件,使用有限差分算法计算出频域的解[15]。在频域中,声压以傅里叶级数展开的形式如下
| $ p\left( {z, r, t} \right) = \sum\limits_{n = - \infty }^{ + \infty } {{C_n}\left( {z, r} \right)\exp \left( {{\rm{j}}n\omega \tau } \right)} $ | (3) |
式中:Cn(z, r)代表第n个谐波分量的复振幅;ω代表HIFU脉冲的基频。
HIFU的热效应使目标区域的局部温度升高,采用生物传热Pennes生物传热方程模拟软组织的温度上升[16-17],Pennes方程的形式如下
| $ \frac{{\partial T}}{{\partial t}} = \frac{k}{{{\rho _0}C}}{\nabla ^2}T + \frac{Q}{{{\rho _0}C}} $ | (4) |
式中:T为温度;C和k代表组织的热容量和热导率;
| $ \frac{{\partial T}}{{\partial t}}\left| {_z} \right. = \frac{k}{{{\rho _0}C}}\frac{{\partial T}}{{\partial {z^2}}} + \frac{Q}{{{\rho _0}C}}, \frac{{\partial T}}{{\partial t}}\left| {_y} \right. = \frac{k}{{{\rho _0}C}}\frac{{\partial T}}{{\partial {y^2}}}, \frac{{\partial T}}{{\partial t}}\left| {_x} \right. = \frac{k}{{{\rho _0}C}}\frac{{\partial T}}{{\partial {x^2}}} $ | (5) |
边界条件为:
根据温度的分布,按照式(6)计算热损伤剂量[18]。
| $ {t_{43}} = \int\limits_{t = 0}^{t = {t_{\rm{f}}}} {{R^{43 - T\left( t \right)}}} {\rm{d}}t $ | (6) |
式中:t43为43 ℃时的热剂量等效时间;tf为加热结束的时间。此公式为经验公式,其物理意义是将热剂量等效为生物组织在43 ℃下热疗的时间。
在仿真计算中,假定凝胶在声学性能和热性能方面都是均匀的。计算到40个谐波为止,使用dr=0.1 mm, dz=0.04 mm的网格间距,并将dt=0.01 s的时间差值作为数值精度与计算成本之间的折衷。凝胶仿体的声学和热学参量为[19-20]:ρ0=1 040 kg·m-3, c0=1 542 m·s-1,C = 4 500 W·s·m-3·℃-1,k=0.6 W·m-1·C-1, α=2.3 Np·m-1, β=4.2, μ=1.1。组织肝脏样本的物理参数:ρb=1 050 kg·m-3, cb=1 596 m·s-1,Cb=3 800 W·s·m-3·℃-1,kb=0.6 W·m-1·C-1, αb=4.5 Np·m-1, βb=6, μb=1.266。
1.2 样品的制备实验中参考Takegami等提出的配方[21],使用含蛋清的光学透明聚丙烯酰胺凝胶作为仿组织体模:每100 ml混合液由43.1 ml除气水、30 ml蛋清、26.2 ml 40%体积比的丙烯酰胺(Acrylamide)水溶液、0.5 ml的10%过硫酸铵水溶液以及0.2 ml四甲基乙二胺(TEMED)。
用直径0.045 mm孔隙的不锈钢筛网将蛋清过滤3次,然后以3 000 r/min的转速离心10 min。将液体放进冰箱静置,直至冷却至43 ℃,这样可以避免聚合反应释放的热能所引起的变性。将冷却后的蛋清液体加入到浓度为40%(质量体积比)的丙烯酰胺(Amresco Inc.美国)及浓度为1.3%(质量体积比)双甲基丙烯酰胺的混合溶液中充分搅拌;再加入过硫酸氨(Amresco Inc.美国)溶液,加入除气水后充分搅拌混合均匀,最后加入四甲基二乙胺(TEMED,Amresco Inc.美国)加速聚合反应,将混合溶液倒入成型容器中,在室温下静置30 min后自然凝固成透明仿体。在超声照射下,鸡蛋清温度上升至58 ℃后,即呈白色不透明状。
实验中组织样品取自本地屠宰场当天出产的新鲜牛肝。将样本均匀切割成10 cm×10 cm×4 cm大小,除气后放入样本架,然后浸在生理盐水中,用HIFU在距样本前1.5 cm处进行聚焦辐照。
1.3 实验系统图 1是实验系统的示意图。采用函数发生器(33250A,Agilent,Santa Clara,CA)产生PRF为100 Hz、脉冲长度为20个周期的1.12 MHz正弦波信号激励信号,经过增益为55 dB的宽带功率放大器(A-150,Electronic Navigation Industries,Rochester,NY)放大后驱动HIFU换能器。HIFU声源声压的较准及声压测量采用一个直径为0.6 mm和频率上限为20 MHz的宽带针水听器(TNU0001A,NTR,Seattle,WA)来完成。基于被动空化检测(Passive cavitation detection, PCD)技术,在不干扰HIFU超声声场的情况下获取空化气泡的活动信息。实验过程中,采用B型超声波扫描仪的5C2-A扫描头(Terasont3000, Division of Teratech Co., Burlinton, MA)监测HIFU引起的空化。为防止扫描头表面产生空化泡群,将扫描头置于一个薄塑料套内(ATL/Philips, Bothell, WA),并在塑料套内填满超声耦合剂。在PC端Labview软件(NI Corp., TX)的操控下,使扫描头随着线性三轴机械扫描系统(Newport ESP7000,USA)移动到焦平面,以此使用B超探头对空化现象进行观察。
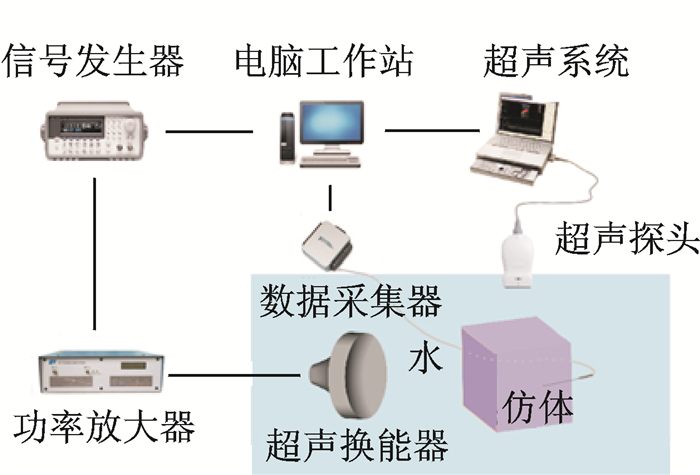
|
图 1 实验系统示意图 Fig. 1 Schematic diagram of experimental system |
损伤实验所用的仿体组织(或声场测量时的水听器)置于HIFU换能器的焦点处,其位置或平面扫描可通过计算机控制精密机械扫描系统(MM3000,Newport,美国)实现。用B超扫描观察HIFU引起的空化区,然后用计算机记录B超图像以便于进一步的图像处理和分析。
1.4 实验方案实验中使用两种不同超声作用参数的HIFU脉冲对生物组织凝胶仿体和肝脏组织进行辐照。两种超声作用参数如下:(1)声压幅值在6.25~9.92 MPa之间变化,脉冲长度固定在2 000个周期;(2)脉冲长度在2 000~6 000个周期之间变化,声压幅值固定为7.5 MPa。
完成凝胶的HIFU辐照后,用数码相机(NEX-6,索尼,日本)拍摄径向和轴向的截面图像。然后,使用Image J软件(NH,USA)对损伤的截面图像进行轮廓勾勒。完成肝脏组织的HIFU辐照后,将组织层层切开,得到最大的热损伤剖面切片;将切片置入37 ℃的1%氯化三苯基四氮唑(TTC)溶液中,当组织中出现清晰的热凝固性坏死边界后,用生理盐水清洗样本,并拍摄照片。参照像素和实际长度之间的比例,根据轮廓的像素对损伤区域的截面进行最后的量化工作。对各种超声作用参数进行3次重复实验。
2 结果与讨论 2.1 HIFU引起的凝胶损伤采用脉冲宽度固定但声压变化,声压固定但脉冲宽度可变两种不同的声学条件作用凝胶仿体,随之产生非对称蝌蚪形损伤,损伤的形状大体呈锥形,边界分明。图 2,3分别显示了声压变化而脉冲长度固定(2 000个周期),以及脉冲长度变化而声压固定(7.5 MPa)的情况下,HIFU所引起损伤的径向及轴向截面图像。较大的声压或脉冲长度会产生较大区域面积的损伤,但脉冲长度或声压振幅的增加引起的损伤面积的加速率却并不一致。图 2中,随着声压振幅从6.25 MPa增加到9.92 MPa,损伤的径向和轴向截面面积均表现为显著的增加,但在图 3中,随着脉冲长度从2 000个周期增加到6 000个周期,损伤的径向截面面积变化不大,只有轴向截面面积显著增加。

|
图 2 HIFU(脉冲长度固定为2 000个周期,声压可变)作用凝胶仿体的径向和轴向损伤截面 Fig. 2 Radial and axial sections of lesion size when the gel being exposed to HIFU with the same pulse length of 2 000 cycles and variable acoustic driving pressure |

|
图 3 HIFU(声压固定为7.5 MPa,脉冲长度可变)作用凝胶仿体的径向和轴向损伤截面 Fig. 3 Radial and axial sections of lesion size when the gel being exposed to HIFU with the same acoustic driving pressure of 7.5 MPa and variable pulse length |
图 4显示的是不同参数下空化区域的轴向截面面积随时间的变化。一旦HIFU开始,空化区域的像素急剧上升,在HIFU之后开始缓慢上升与波动。
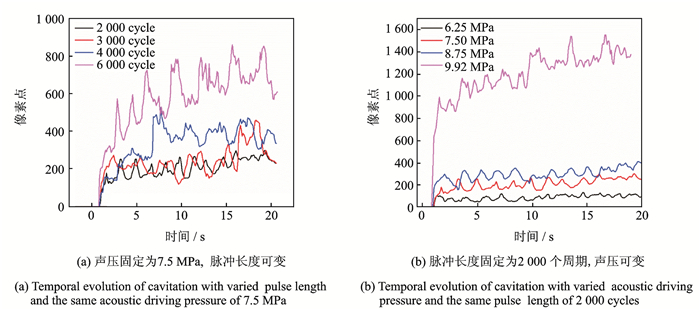
|
图 4 空化面积随时间的变化 Fig. 4 Change of cavitation area with time |
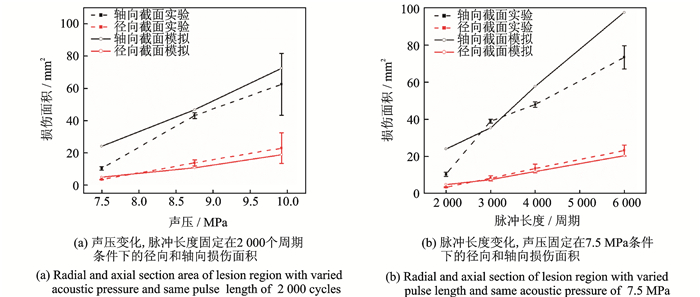
为了定量研究损伤面积随超声激振参数的变化情况,在图像处理后对其轴向和径向的截面面积进行量化。图 5显示了损伤区域的轴向和径向截面随声压或脉冲长度的变化,其中实线表示模拟结果,虚线表示实验测量数据。图 5(a)为脉冲长度固定在2 000个周期,声压变化;而图 5(b)为声压振幅固定在7.5 MPa时,脉冲长度变化。由图可见,随着声压幅度从6.25 MPa增加到9.92 MPa,或脉冲长度从2 000增加到6 000个周期,计算和测量的损伤径向截面面积也随之增加。但轴向截面面积与径向不同的是,在测量和模拟结果中,轴向截面面积均表现为很高的加速率。更重要的是,实验测量和计算模拟的轴向截面面积之间存在明显的差异,尤其是当声压和脉冲长度达到相对较高的值时。这种现象的原因将在后面进行讨论。
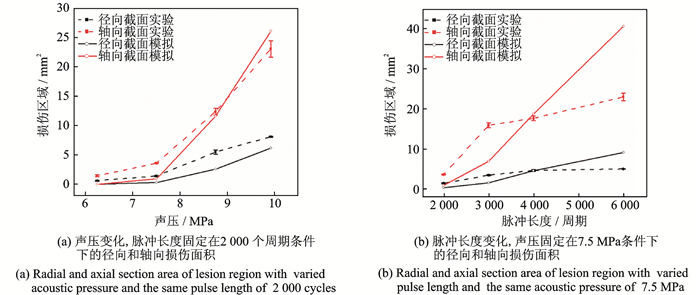
|
图 5 凝胶仿体中计算与实验测量的损伤面积 Fig. 5 Experimental and numerical results of the area of lesion region in gel |
2.2 HIFU引起的肝组织损伤
由于肝脏组织与凝胶仿体不同,具有非透明性,因此肝脏样本的轴向和径向截面损伤的图像不能同时获得。本文实验只获取了相对更有研究意义的损伤轴向截面图像。图 6, 7为肝组织在接受不同声压或不同脉冲长度的HIFU辐照时所得损伤的截面图像。由图可见,较大声压或更长脉冲长度的HIFU辐照中会产生较大面积的损伤,这与凝胶仿体中观察到的实验结果类似。
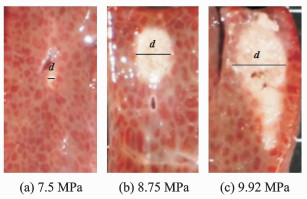
|
图 6 HIFU(脉冲长度固定为2 000个周期,不同声压)辐照时,肝组织损伤的轴向截面图像 Fig. 6 Axial sections of lesion size when the beef liver being exposed to HIFU with same pulse length of 2 000 cycles and variable acoustic driving pressure |
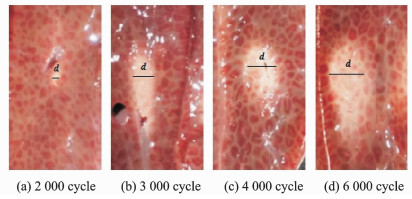
|
图 7 HIFU(声压固定为7.5 MPa,不同脉冲长度)辐照时,肝组织损伤的轴向截面图像 Fig. 7 Axial sections of lesion size when the beef liver being exposed to HIFU with same acoustic driving pressure of 7.5 MPa and variable pulse length |
图 8表明计算和测量所得的损伤径向截面面积,随着声压幅度从7.5 MPa增加到9.92 MPa而逐渐增大,而径向截面面积与脉冲长度的曲线也表现出类似的趋势。此外,与凝胶仿体中的损伤相比(图 5),在相同的超声作用参数下,肝脏样本表现为更大的损伤。这是因为相对于凝胶仿体而言肝脏组织本身具有更高的声速和更小的比热容。
|
图 8 肝组织中计算与实验测量的损伤面积 Fig. 8 Experimental and numerical results of the area of lesion region in beef liver |
2.3 空化对损伤形成的影响
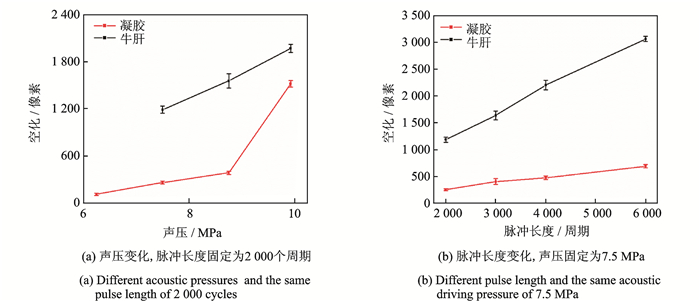
HIFU引起的空化气泡云在B超图像中表现为高回声区,本文在实验中采用B型超声监控系统使上述高回声区可视化[22]。如图 9所示,根据像素完成凝胶仿体和肝脏组织样本中所产生的最大空化气泡云区域的定量计算,并绘制出声压和脉冲长度为变量的函数图像。随着声压和脉冲长度的增加,声能沉积上升,产生的空化气泡也明显增多。而且与凝胶仿体相比,在肝脏样本中观察到的空化更为强烈,可能是由于肝脏样本自身的不均匀性所致。
|
图 9 凝胶仿体和肝脏样本中HIFU引起的空化气泡云的最大面积 Fig. 9 The maximum of pixel of cavitation in gel and beef liver caused by HIFU |
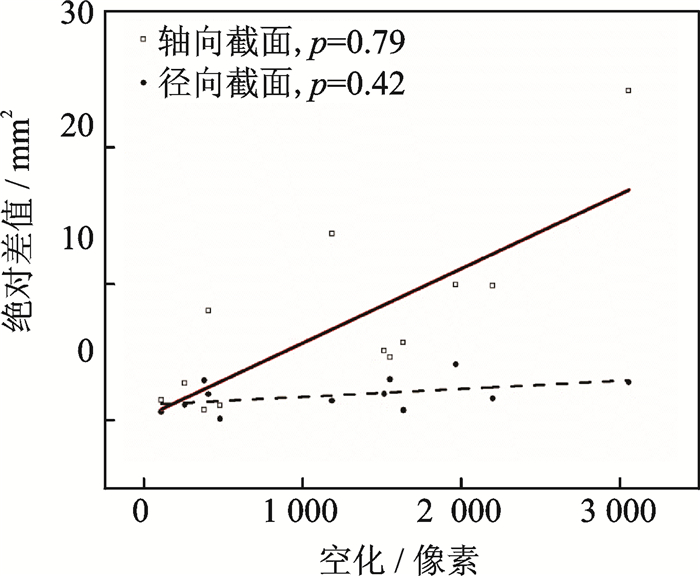
为了研究HIFU所引起的空化在轴向和径向上对仿真模拟与实验测量值之间差异的影响,本文对损伤截面面积的汇总数据进行了统计分析。如图 10所示,轴向损伤截面面积的偏差与空化的增强之间呈近似线性相关,相关系数p为0.79,而径向截面的损伤形成与HIFU引起的空化强度没有明显的相关性, 相关系数p为0.42。
|
图 10 仿真模拟与实验测量值之间的差异与空化的关系 Fig. 10 Relationship between the differences within experimental and numerical results and the cavitation |
上述结果表明,HIFU引起的空化可以随着声学驱动参数的增加而增强(图 9),超声焦域的声空化能够大幅提高组织加热速率(图 10),这与以前的研究结论一致[23-24]。但是,当声学驱动参数(如焦点声压或脉冲长度)增加到一定水平时,随之增强到一定程度的空化效应就会因为大量气泡的存在而阻碍声波传播,并会产生更多复杂而不可控的生物效应,减弱声场传递给目标区域即聚焦域的超声能量,最终对HIFU引起的热损伤反而会造成负面影响,减弱HIFU的治疗效应。从凝胶实验的结果来看,当声压不超过约9 MPa或脉冲长度不超过约3 800个周期时,空化效应对HIFU治疗效果有增强作用,具体体现在实验测得的HIFU损伤面积值超过模拟仿真的计算值;而当声压大于约9 MPa或脉冲长度大于约3 800个周期时会产生过度空化,并对HIFU治疗效果产生抑制,具体体现在此时损伤面积的实验值小于模拟仿真的计算值。而且,引起过度空化的声学驱动参数阈值的测定是一个复杂的过程,还需要更进一步的实验研究。
3 结束语空化气泡能加速损伤区域的形成和发展,且在不同声压下,会产生不同种类的损伤形状[13]。本文针对凝胶仿体和体外肝脏组织样本,根据多种声激励参数(声压振幅和脉冲长度),从理论及实验两方面研究了空化对HIFU温升和损伤形成的影响。结果表明:
(1) 较大的声压或较长的脉冲长度可以使焦域产生较高的温度,导致较大面积的损伤。
(2) HIFU引起的空化气泡云能够显著影响轴向损伤的形成,而径向损伤的形成则与空化的相关性较低,因此使用理论模型更容易进行模拟。
(3) 过度空化对于HIFU引起的组织加热和损伤形成可能是有害的,因为这可能会导致HIFU治疗产生无法控制的生物效应。
本文的研究结果将有助于更好地了解空化效应对HIFU的温升和热损伤形成的影响,有助于实现更安全而有效的HIFU治疗。
| [1] |
Holt R G, Roy R A. Measurements of bubble-enhanced heating from focused, MHz-frequency ultrasound in a tissue-mimicking material[J]. Ultrasound in Medicine and Biology, 2001, 27(10): 1399-1412. |
| [2] |
Miller D L, Gies R A. The interaction of ultrasonic heating and cavitation in vascular bioeffects on mouse intestine[J]. Ultrasound in Medicine Biology, 1998, 24(1): 123-128. |
| [3] |
Chen W S, Lafon C, Matula T J, et al. Mechanisms of lesion formation in high intensity focused ultrasound therapy[J]. Acoustics Research Letters Online, 2003, 4(2): 41-46. DOI:10.1121/1.1559911 |
| [4] |
Farny C H. Identifying and monitoring the roles of cavitation in heating from high intensity focused ultrasound[M]. Boston: Boston University, 2006.
|
| [5] |
Chen T, Qiu Y Y, Fan T B, et al. Modeling of shock wave generated from a strong focused ultrasound transducer[J]. Chinese Physics Letters, 2013, 30(7): 074302. DOI:10.1088/0256-307X/30/7/074302 |
| [6] |
Bailey M R, Khokhlova V A, Sapozhnikov O A, et al. Physical mechanisms of the therapeutic effect of ultrasound[J]. Acoustical Physics, 2003, 49(4): 437-464. |
| [7] |
Hynynen K. Demonstration of enhanced temperature elevation due to nonlinear propagation of focused ultrasound in dog's thigh muscle in vivo[J]. Ultrasound in Medicine and Biology, 1987, 13(2): 85-91. |
| [8] |
Filonenko E A, Ter Haar G R, Rivens I, et al. Prediction of ablation volume for different HIFU exposure regimes[C]//3rd International Symposium on Therapeutic Ultrasound. Lyon, France: [s. n. ], 2003: 268-274.
|
| [9] |
Church C C. Spontaneous homogeneous nucleation, inertial cavitation and the safety of diagnostic ultrasound[J]. Ultrasound in Medicine and Biology, 2002, 28(10): 1349-1364. |
| [10] |
Miller M W, Everbach E C, Miller W M, et al. Biological and environmental factors affecting ultrasound-induced hemolysis in vitro:2. Medium dissolved gas (PO2) content[J]. Ultrasound in Medicine and Biology, 2003, 29(1): 93-102. |
| [11] |
Holland C K, Apfel R E. Thresholds for transient cavitation produced by pulsed ultrasound in a controlled nuclei environment[J]. Journal of the Acoustical Society of America, 1990, 88(5): 2059-2069. DOI:10.1121/1.400102 |
| [12] |
Hynynen K. The threshold for thermally significant cavitation in dog thigh muscle in vivo[J]. Ultrasound in Medicine and Biology, 1991, 17(2): 157-169. |
| [13] |
Khokhlova V A, Bailey M R, Reed J A, et al. Effects of nonlinear propagation, cavitation, and boiling in lesion formation by high intensity focused ultrasound in a gel phantom[J]. Journal of the Acoustical Society of America, 2006, 119(3): 1834-1848. DOI:10.1121/1.2161440 |
| [14] |
Kuznetsov V P. Equation of nonlinear acoustics[J]. Soviet Physics on Acoustics, 1971, 16(4): 467-470. |
| [15] |
Filonenko E A, Khohlova V A. Effect of acoustic nonlinearity on heating of biological tissue by high intensity focused ultrasound[J]. Acoustical Physics, 2001, 47(4): 541-549. |
| [16] |
Zhao X, Mcgough R J. The Khokhlov-Zabolotskaya-Kuznetsov (KZK) equation with power law attenuation[C]//IEEE International Ultrasonics Symposium. Chicago, USA: IEEE, 2014: 2225-2228.
|
| [17] |
Canney M S, Bailey M R, Crum L A, et al. Acoustic characterization of high intensity focused ultrasound fields:A combined measurement and modeling approach[J]. Journal of the Acoustical Society of America, 2008, 124(4): 2406-2420. DOI:10.1121/1.2967836 |
| [18] |
Khokhlova T D, Canney M S, Lee D, et al. Magnetic resonance imaging of boiling induced by high intensity focused ultrasound[J]. Journal of the Acoustical Society of America, 2009, 125(4): 2420-2431. DOI:10.1121/1.3081393 |
| [19] |
Pennes H H. Analysis of tissue and arterial blood temperature in the resting human forearm[J]. Journal of Applied Physiology, 1948, 1(2): 93-122. DOI:10.1152/jappl.1948.1.2.93 |
| [20] |
Sapareto S A, Dewey W C. Thermal dose determination in cancer therapy[J]. International Journal of Radiation Oncology Biology Physics, 1984, 10(6): 787-800. DOI:10.1016/0360-3016(84)90379-1 |
| [21] |
Takegami K, Kaneko T, Watanabe T, et al. Polyacrylamide gel containing egg white as new model for irradiation experiments using focused ultrasound[J]. Ultrasound in Medicine and Biology, 2004, 30(10): 1419-1422. |
| [22] |
Lafon C, Zderic V, Noble M L, et al. Gel phantom for use in high-intensity focused ultrasound dosimetry[J]. Ultrasound in Medicine and Biology, 2005, 31(10): 1383-1389. DOI:10.1016/j.ultrasmedbio.2005.06.004 |
| [23] |
Everett I V T H, Lee K W, Wilson E E, et al. Safety profiles and lesion size of different radiofrequency ablation technologies:A comparison of large tip, open and closed irrigation catheters[J]. Journal of Cardiovascular Electrophysiology, 2009, 20(3): 325-335. DOI:10.1111/j.1540-8167.2008.01305.x |
| [24] |
Zhang Z, Chen T, Zhang D. Lesions in porcine liver tissues created by continuous high intensity ultrasound exposures in vitro[J]. Chinese Physics Letters, 2013, 30(2): 024302. DOI:10.1088/0256-307X/30/2/024302 |
 2018, Vol. 33
2018, Vol. 33

